Morfologie GIST
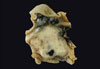
Makroskopický nález
Souhrnné studie udávají největší výskyt těchto nádorů v žaludku (60-70%), dále následuje tenké střevo (20-25%), tlusté střevo (5%) a jícen (<5%) (1, 2). Méně často se stromální tumory nacházejí mimo trávicí trubici (někteří autoři je nazývají EGISTy, tedy extragastrointestinální stromální tumory), a to v mesenteriu, omentu a retroperitoneu (3-7), vzácně v pankreatu (7, 8) a žlučníku (9-11), a ojedinělé práce popisují primární (E)GIST i v seróze močového měchýře (12), prostatě (13, 14), vagině (15, 16) děloze (17, 18), játrech (19-21) a dokonce i na pleuře (22).
Při své nejčastější lokalizaci v trávicí trubici vycházejí z některé vrstvy pod sliznicí gastrointestinální stěny (nejčastěji z muscularis propria) a vyklenují se většinou do lumina, případně na serózní povrch žaludku či střeva. Často dochází k ulceraci přilehlé sliznice. Tumory bývají dobře ohraničené, někdy s tenkou pseudokapsulou, z níž mohou do nádoru vybíhat septa rozdělující jej na pseudolobuly. Jejich konzistence je elastická, pokud není změněna regresivními změnami. Struktura na řezu bývá (hlavně u malých tumorů) homogenní až naznačeně vláknitá, barva bílá. Sekundárně však může být tento obraz změněn regresivními změnami jako nekrózou, prokrvácením, kalcifikací nebo pseudocystickou přeměnou (23, 24).
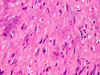
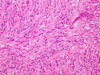
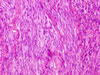
Histologický nález
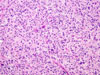
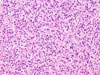
Konvenční světelná mikroskopie ve většině případů umožňuje s vysokou mírou jistoty diagnózu gastrointestinálního stromálního tumoru i před konfirmačním imunohistochemickým vyšetřením.
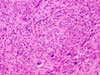
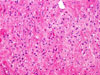
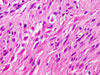
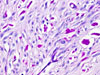
Klasicky se GISTy rozdělují na dvě hlavní skupiny: vřetenobuněčné a epiteloidní. Tyto dva druhy buněk mohou být uspořádány fascikulárně, storiformně, difúzně, alveolárně nebo vytvářet organoidní struktury. Navíc četné tumory mají smíšený fenotyp. Miettinen et al. v roce 2005 navrhl bližší subklasifikaci těchto dvou typů na základě studie rozsáhlého souboru GISTů žaludku (24):
- Vřetenobuněčné GISTy
- Sklerózující: paucicelulární proliferace tenkých vřetenitých buněk bez atypií a mitóz, s abundantním kolagenním stromatem.
- Palisádované vakuolizované: jsou celulárnější, nádorové buňky dužnatější, s jaderným palisádováním a perinukleárními vakuolami, jen s mírnými atypiemi a nízkou mitotickou aktivitou.
- Hypercelulární: obdobný předešlému, ale výrazně celulární a s mitotickým indexem dosahujícím až 15/50 HPF.
- Sarkomatózní: tvořený výrazně atypickými vřetenitými až oválnými buňkami, mitotický index přesahuje 20/50 HPF.
- Epiteloidní GISTy
- Sklerózující syncytiální: tvořený uniformními polygonálními buňkami s nezřetelným rozhraním mezi buňkami v kolagenní matrix. Mitotická aktivita je jen mírná, součástí nádoru mohou být mnohojaderné buňky.
- Dyskohezivní: velké polygonální buňky zde mají zřetelné hranice, některé také mohou být mnohojaderné, matrix je přítomna v malém množství, mitotická aktivita stále mírná, stejně jako případné fokální atypie.
- Hypercelulární: obdobný předešlému, ale s jadernými atypiemi a vyšší mitotickou aktivitou nepřesahující však 10/50 HPF.
- Sarkomatózní: proliferace epiteloidních až kulatých buněk s vysokým nukleoplasmatickým poměrem, výraznými jadérky a vysokou mitotickou aktivitou.
Dalšími diagnosticky přínosnými znaky jsou: perinukleární vakuolizace, skeinoidní vlákna (globulární eosinofilní, PAS-pozitivní hmoty, jejichž ultrastruktura je tvořena 30-48 nm silnými fibrilami paralelně uspořádanými a propojenými 7-15 nm silnými „tenkými filamenty“, přičemž místa spojení těchto dvou typů fibril vytvářejí žíhání skeinoidních vláken o periodicitě 41-48 nm) (25, 26), a v neposlední řadě myxoidní vzhled, který je v kombinaci s predominancí epiteloidních buněk, přítomností buněk vícejaderných a především infiltrací mastocyty, signifikantním znakem GISTů s mutací genu PDGFRA (24, 27-31).
Imunohistochemické vyšetření
CD117 (KIT): zlatý standard v konfirmaci diagnózy GIST, negativita však tuto diagnózu nevylučuje. Naopak bývá pozitivní i v některých lézích spadajících do diferenciální diagnózy GISTu (viz samostaný oddíl).
PDGFRA: pozitivní především v GISTech s mutací v PDGFRA genu. Ve studovaných souborech však byla exprese pozitivní až ve 25% případů jiných lézí než GIST, zejména v intraabdominálním desmoidu (fibromatóze), schwannomu, leiomyocelulárních nádorech a různých jiných sarkomech, navíc kvalita dostupných komerčních protilátek je suboptimální (32-34).
DOG1 (discovered on GIST-1): kalcium dependentní receptorem řízený chloridový kanál, jehož gen se nachází v lokusu CCND1-EMS1 na 11. chromozomu, exprimovaný téměř ve všech GISTech (mutovaných jak v KIT tak PDGFRA), negativní v desmoidu, ale pozitivní v malé části synoviálních sarkomů, leiomyosarkomů, fibrosarkomů, ES/PNET, maligním melanomu, některých karcinomech a solidně-pseudopapilárním nádoru pankreatu (35, 36). Přesto se však tato protilátka (konkrétně klon K9) v současné době jeví pro svou vysokou senzitivitu i specificitu jako nejspolehlivější marker GIST (37, 38). Exprese DOG1 v GISTech není podmíněna mutací jeho genu (39).
PKC-θ (protein kináza C – theta): tato isoforma proteinkinázy C z rodiny serin/threoninových kináz je imunopozitivní ve většině GISTů. Navzdory původním zprávám o její úplné specificitě v diferenciální diagnostice mesenchymálních nádorů trávicího traktu byla však později zjištěna její přítomnost také v řadě dalších mesenchymálních lézí, včetně schwannomů a hladkosvalových nádorů. Pro svou nízkou specificitu se tedy tento marker v současné době jeví jako jen málo použitelný (37, 38, 40-42).
CD34: před érou KIT používána protilátka proti tomuto proteinu, označovanému jako antigen hemopoetických progenitorových buněk, k odlišení GISTu od hladkosvalových nádorů. Vzhledem ke své nízké specificitě má dnes velmi omezený význam jen v rámci rozsáhlejšího imunohistochemického vyšetření (38).
hladkosvalové markery: v souladu s možnou parciální leiomyocelulární diferenciací GISTu mohou být pozitivní, zejména hladkosvalový aktin, většinou však fokálně a slabě. Desmin bývá v GISTech pozitivní jen vzácně, naopak h-caldesmon je typicky pozitivní navzdory proklamované specificitě pro hladkou svalovinu (43).
S100 protein: v některých studiích pozitivní až v 10% GISTů, dle našich zkušeností je však jeho exprese v GISTech mnohem vzácnější a spíše by měla vzbudit podezření na schwannom.
neurální markery: bývají pozitivní zejména u tumorů dříve diagnostikovaných jako GANT, zejména neuron specifická enoláza, tau protein a synaptofyzin (44, 45).
Thy-1 (CD90): nejmenší zástupce imunoglobulinové superrodiny, jehož senzitivita se v diagnostice GISTu blíží senzitivitě CD117, specificita je však poměrně nízká, neboť bývá exprimován i v neuronálních tumorech, plicních karcinomech nebo AML. Význam má tedy spíše jako slibný cíl protinádorové imunoterapie (46).
ETV1: zástupce rodiny transkripčních faktorů ETS (E-twenty six), která byla pojmenována po svém prvním objeveném členu (v-ets), fúzním onkogenu způsobujícím ptačí leukémii přenášenou virem E26. Samotný ETV1 řídí transkripční program Cajalových interstitiálních buněk a v kooperaci s aktivovaným KIT proteinem se pravděpodobně podílí na tumorigenezi GISTu. Z toho důvodu se v současné době jeví jako slibný senzitivní marker GISTu, zatím však nebyla ve větších studiích stanovena jeho specificita (47).
Elektronová mikroskopie
Ultrastruktura nemá v současné době, při dostupnosti imunohistochemického a molekulárně genetického vyšetření, a po zavržení GANTu jako samostatné jednotky žádný diagnostický, prognostický ani prediktivní význam (48-50).
Závěrečné diagnostické doporučení
Přestože ve většině případů má GIST charakteristický morfologický obraz již v konvenčním barvení hematoxylinem a eosinem, je třeba tuto diagnózu konfirmovat imunohistochemicky. K této konfirmaci by rutinně měla sloužit sada tří protilátek (CD117, desmin, S100), přičemž jiný než typický výsledek, kterým je pozitivita CD117 a negativita desminu a S100 proteinu, by měl vést k odeslání případu na specializované pracoviště se zkušenostmi v diagnostice GISTu, vybavené dalšími imunohistochemickými markery (zejména DOG1) a provádějící molekulárně genetické vyšetření genů KIT a PDGFRA.
- Miettinen M, Sarlomo-Rikala M, Lasota J. Gastrointestinal stromal tumors: recent advances in understanding of their biology. Hum Pathol 1999; 30(10): 1213-1220.
- Miettinen M, Lasota J. Gastrointestinal stromal tumors--definition, clinical, histological, immunohistochemical, and molecular genetic features and differential diagnosis. Virchows Arch 2001; 438(1): 1-12.
- Miettinen M, Monihan JM, Sarlomo-Rikala M, et al. Gastrointestinal stromal tumors/smooth muscle tumors (GISTs) primary in the omentum and mesentery: clinicopathologic and immunohistochemical study of 26 cases. Am J Surg Pathol 1999; 23(9): 1109-1118.
- Reith JD, Goldblum JR, Lyles RH, Weiss SW. Extragastrointestinal (soft tissue) stromal tumors: an analysis of 48 cases with emphasis on histologic predictors of outcome. Mod Pathol 2000; 13(5): 577-585.
- Sakurai S, Hishima T, Takazawa Y, et al. Gastrointestinal stromal tumors and KIT-positive mesenchymal cells in the omentum. Pathol Int 2001; 51(7): 524-531.
- Clary BM, DeMatteo RP, Lewis JJ, Leung D, Brennan MF. Gastrointestinal stromal tumors and leiomyosarcoma of the abdomen and retroperitoneum: a clinical comparison. Ann Surg Oncol 2001; 8(4): 290-299.
- Neto MR, Machuca TN, Pinho RV, Yuasa LD, Bleggi-Torres LF. Gastrointestinal stromal tumor: report of two unusual cases. Virchows Arch 2004; 444(6): 594-596.
- Daum O, Klecka J, Ferda J, et al. Gastrointestinal stromal tumor of the pancreas: case report with documentation of KIT gene mutation. Virchows Arch 2005; 446(4): 470-472.
- Ortiz-Hidalgo C, de Leon Bojorge B, Albores-Saavedra J. Stromal tumor of the gallbladder with phenotype of interstitial cells of Cajal: a previously unrecognized neoplasm. Am J Surg Pathol 2000; 24(10): 1420-1423.
- Mendoza-Marin M, Hoang MP, Albores-Saavedra J. Malignant stromal tumor of the gallbladder with interstitial cells of Cajal phenotype. Arch Pathol Lab Med 2002; 126(4): 481-483.
- Furihata M, Fujimori T, Imura J, et al. Malignant stromal tumor, so called "gastrointestinal stromal tumor", with rhabdomyomatous differentiation occurring in the gallbladder. Pathol Res Pract 2005; 201(8-9): 609-613.
- Lasota J, Carlson JA, Miettinen M. Spindle cell tumor of urinary bladder serosa with phenotypic and genotypic features of gastrointestinal stromal tumor. Arch Pathol Lab Med 2000; 124(6): 894-897.
- Van der Aa F, Sciot R, Blyweert W, et al. Gastrointestinal stromal tumor of the prostate. Urology 2005; 65(2): 388.
- Lee CH, Lin YH, Lin HY, Lee CM, Chu JS. Gastrointestinal stromal tumor of the prostate: a case report and literature review. Hum Pathol 2006; 37(10): 1361-1365.
- Ceballos KM, Francis JA, Mazurka JL. Gastrointestinal stromal tumor presenting as a recurrent vaginal mass. Arch Pathol Lab Med 2004; 128(12): 1442-1444.
- Lam MM, Corless CL, Goldblum JR, et al. Extragastrointestinal stromal tumors presenting as vulvovaginal/rectovaginal septal masses: a diagnostic pitfall. Int J Gynecol Pathol 2006; 25(3): 288-292.
- Wingen CB, Pauwels PA, Debiec-Rychter M, van Gemert WG, Vos MC. Uterine gastrointestinal stromal tumour (GIST). Gynecol Oncol 2005; 97(3): 970-972.
- Terada T. Gastrointestinal stromal tumor of the uterus: a case report with genetic analyses of c-kit and PDGFRA genes. Int J Gynecol Pathol 2009; 28(1): 29-34.
- Hu X, Forster J, Damjanov I. Primary malignant gastrointestinal stromal tumor of the liver. Arch Pathol Lab Med 2003; 127(12): 1606-1608.
- De Chiara A, De Rosa V, Lastoria S, et al. Primary gastrointestinal stromal tumor of the liver with lung metastases successfully treated with STI-571 (imatinib mesylate). Front Biosci 2006; 11): 498-501.
- Yamamoto H, Miyamoto Y, Nishihara Y, et al. Primary gastrointestinal stromal tumor of the liver with PDGFRA gene mutation. Hum Pathol 2010; 41(4): 605-609.
- Long KB, Butrynski JE, Blank SD, et al. Primary extragastrointestinal stromal tumor of the pleura: report of a unique case with genetic confirmation. Am J Surg Pathol 2010; 34(6): 907-912.
- Stout AP. Bizarre smooth muscle tumors of the stomach. Cancer 1962; 15): 400-409.
- Miettinen M, Sobin LH, Lasota J. Gastrointestinal stromal tumors of the stomach: a clinicopathologic, immunohistochemical, and molecular genetic study of 1765 cases with long-term follow-up. Am J Surg Pathol 2005; 29(1): 52-68.
- Min KW. Small intestinal stromal tumors with skeinoid fibers. Clinicopathological, immunohistochemical, and ultrastructural investigations. Am J Surg Pathol 1992; 16(2): 145-155.
- Hemmi A, Inaniwa Y, Ohno S, et al. Relationship between skeinoid fibers and stromal matrix in gastrointestinal stromal tumors: morphometric analysis with quick-freezing and deep-etching method. Pathol Int 2001; 51(5): 338-348.
- Sakurai S, Hasegawa T, Sakuma Y, et al. Myxoid epithelioid gastrointestinal stromal tumor (GIST) with mast cell infiltrations: a subtype of GIST with mutations of platelet-derived growth factor receptor alpha gene. Hum Pathol 2004; 35(10): 1223-1230.
- Wardelmann E, Hrychyk A, Merkelbach-Bruse S, et al. Association of platelet-derived growth factor receptor alpha mutations with gastric primary site and epithelioid or mixed cell morphology in gastrointestinal stromal tumors. J Mol Diagn 2004; 6(3): 197-204.
- Pauls K, Merkelbach-Bruse S, Thal D, Buttner R, Wardelmann E. PDGFRalpha- and c-kit-mutated gastrointestinal stromal tumours (GISTs) are characterized by distinctive histological and immunohistochemical features. Histopathology 2005; 46(2): 166-175.
- Penzel R, Aulmann S, Moock M, et al. The location of KIT and PDGFRA gene mutations in gastrointestinal stromal tumours is site and phenotype associated. J Clin Pathol 2005; 58(6): 634-639.
- Daum O, Grossmann P, Vanecek T, et al. Diagnostic morphological features of PDGFRA-mutated gastrointestinal stromal tumors: molecular genetic and histologic analysis of 60 cases of gastric gastrointestinal stromal tumors. Ann Diagn Pathol 2007; 11(1): 27-33.
- Rossi G, Valli R, Bertolini F, et al. PDGFR expression in differential diagnosis between KIT-negative gastrointestinal stromal tumours and other primary soft-tissue tumours of the gastrointestinal tract. Histopathology 2005; 46(5): 522-531.
- Peterson MR, Piao Z, Weidner N, Yi ES. Strong PDGFRA Positivity Is Seen in GISTs But Not in Other Intra-abdominal Mesenchymal Tumors: Immunohistochemical and Mutational Analyses. Appl Immunohistochem Mol Morphol 2006; 14(4): 390-396.
- Medeiros F, Corless CL, Duensing A, et al. KIT-negative gastrointestinal stromal tumors: proof of concept and therapeutic implications. Am J Surg Pathol 2004; 28(7): 889-894.
- West RB, Corless CL, Chen X, et al. The novel marker, DOG1, is expressed ubiquitously in gastrointestinal stromal tumors irrespective of KIT or PDGFRA mutation status. Am J Pathol 2004; 165(1): 107-113.
- Bergmann F, Andrulis M, Hartwig W, et al. Discovered on gastrointestinal stromal tumor 1 (DOG1) is expressed in pancreatic centroacinar cells and in solid-pseudopapillary neoplasms-novel evidence for a histogenetic relationship. Hum Pathol 2011; 42(6): 817-823.
- Wong NA, Shelley-Fraser G. Specificity of DOG1 (K9 clone) and protein kinase C theta (clone 27) as immunohistochemical markers of gastrointestinal stromal tumour. Histopathology 2010; 57(2): 250-258.
- Novelli M, Rossi S, Rodriguez-Justo M, et al. DOG1 and CD117 are the antibodies of choice in the diagnosis of gastrointestinal stromal tumours. Histopathology 2010; 57(2): 259-270.
- Miwa S, Nakajima T, Murai Y, Takano Y, Sugiyama T. Mutation assay of the novel gene DOG1 in gastrointestinal stromal tumors (GISTs). J Gastroenterol 2008; 43(7): 531-537.
- Blay P, Astudillo A, Buesa JM, et al. Protein kinase C theta is highly expressed in gastrointestinal stromal tumors but not in other mesenchymal neoplasias. Clin Cancer Res 2004; 10(12 Pt 1): 4089-4095.
- Motegi A, Sakurai S, Nakayama H, et al. PKC theta, a novel immunohistochemical marker for gastrointestinal stromal tumors (GIST), especially useful for identifying KIT-negative tumors. Pathol Int 2005; 55(3): 106-112.
- Miquel R, Gaspa A, Perez N, et al. Protein kinase C theta (PKC-theta) selective expression in gastrointestinal stromal tumors. (Abstract). Mod Pathol 2005; 18(suppl 1): 113A.
- Miettinen MM, Sarlomo-Rikala M, Kovatich AJ, Lasota J. Calponin and h-caldesmon in soft tissue tumors: consistent h-caldesmon immunoreactivity in gastrointestinal stromal tumors indicates traits of smooth muscle differentiation. Mod Pathol 1999; 12(8): 756-762.
- Segal A, Carello S, Caterina P, Papadimitriou JM, Spagnolo DV. Gastrointestinal autonomic nerve tumors: a clinicopathological, immunohistochemical and ultrastructural study of 10 cases. Pathology (Phila) 1994; 26(4): 439-447.
- Chambonniere ML, Mosnier-Damet M, Mosnier JF. Expression of microtubule-associated protein tau by gastrointestinal stromal tumors. Hum Pathol 2001; 32(11): 1166-1173.
- Oikonomou D, Hassan K, Kaifi JT, et al. Thy-1 as a potential novel diagnostic marker for gastrointestinal stromal tumors. J Cancer Res Clin Oncol 2007; 133(12): 951-955.
- Chi P, Chen Y, Zhang L, et al. ETV1 is a lineage survival factor that cooperates with KIT in gastrointestinal stromal tumours. Nature 2010; 467(7317): 849-853.
- Lee JR, Joshi V, Griffin JW, Jr., Lasota J, Miettinen M. Gastrointestinal autonomic nerve tumor: immunohistochemical and molecular identity with gastrointestinal stromal tumor. Am J Surg Pathol 2001; 25(8): 979-987.
- Debiec-Rychter M, Pauwels P, Lasota J, et al. Complex genetic alterations in gastrointestinal stromal tumors with autonomic nerve differentiation. Mod Pathol 2002; 15(7): 692-698.
- Lee JR, Lasota J. Gastrointestinal autonomic nerve tumor (author´s reply). Am J Surg Pathol 2002; 26(3): 397-398.